苯酚是一类重要的基础化工原料,其来源广泛,可通过木质素降解生产,是一类理想的苯胺前体。但由于苯酚具有较强的亲核能力,并且C-O键能(111 kcal/mol)远大于O-H键能(88 kcal/mol);因此,在均相过渡金属催化的反应中,需要将酚羟基预先活化再进行芳基C-O键的切断。例如:将苯酚制备成高活性的三氟甲磺酸芳基酯,再通过钯或镍等催化的胺化反应来获得苯胺(图1a)。为突破Bucherer反应局限于萘酚,在外加(内)氢源存在条件下,Pd/C等非均相催化剂被发展应用于苯酚与胺的缩合(图1b)。具体来说,苯酚加氢生成环己酮或烯酮中间体,与胺缩合后通过脱氢芳构化制得苯胺。
本文作者基于课题组所发展的过渡金属η6-配位催化的氟苯SNAr(芳香亲核取代)反应体系,设计利用铑(III)催化剂通过η6-配位来驱动苯酚的“酚-酮”互变,将亲核性的苯酚转变为亲电性的酮式η5-配合物,为与胺类亲核试剂缩合提供契机。

图1. 苯酚胺化。图片来源:J. Am. Chem. Soc.
作者以对甲基苯酚和哌啶作为模板底物,通过实验摸索得以发现配体具有3,5-双三氟甲基苯基取代的催化剂[CpdiCF3Rh(III)]2+是最为有效的。该催化反应适用一系列电中性、供电子、吸电子取代的苯酚,对于酯基、氨基、酰胺、硅醚等官能团可以较好地兼容(图2)。值得注意的是,杂环结构如吡啶、四氢喹啉等也可以兼容。
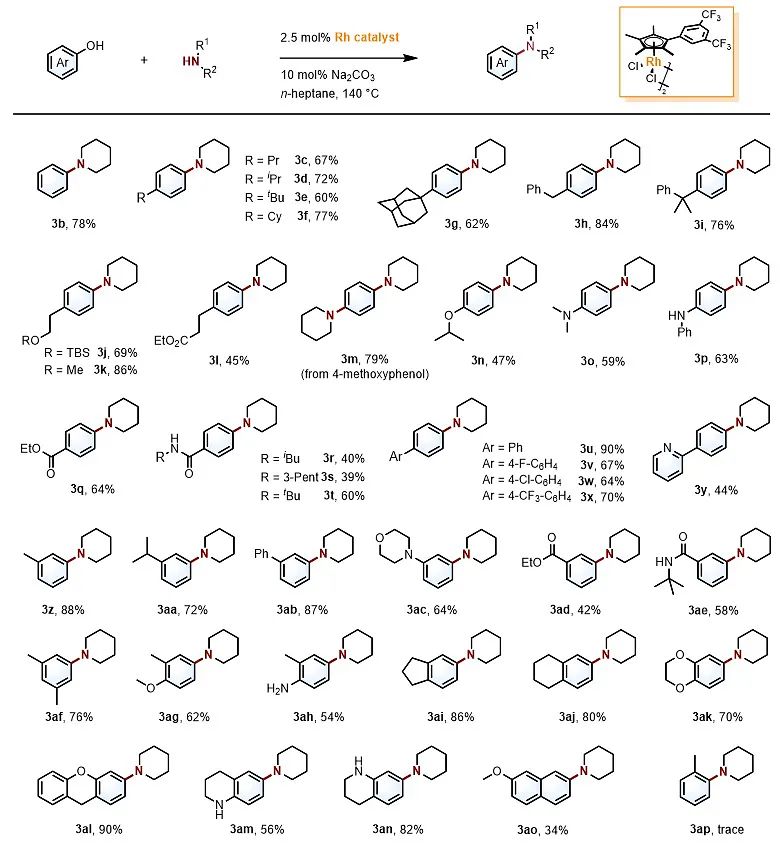
图2. 苯酚底物范围。图片来源:J. Am. Chem. Soc.
该方法适用于不同取代基的一级、二级胺,具有广泛的官能团兼容性,例如:卤素、酰胺、酯基、氨基、Boc保护的氨基、醇羟基、吡啶、嘧啶、硅醚等。对于螺环、桥环结构的胺也能较好的兼容,进一步说明了该方法的普适性。值得一提的是,对于在过渡金属存在下易发生β-H消除的苄胺类化合物也能与苯酚进行胺化(图3)。此外,该胺化方法已被用于具有复杂结构药物分子及其衍生物的Late-Stage官能团化(详见原文)。

图3. 胺底物范围。图片来源:J. Am. Chem. Soc.
接着,作者进行了一系列机理实验(图4)。首先,对于反应过程的监测,发现随着时间的进行,哌啶2a逐渐转化为产物3a,体系内观测不到任何的H-转移中间体,如亚胺、环己酮、环己烯酮(图3a)。接着,利用α-氘代十二胺(98%D)与对甲基苯酚在标准条件下进行反应,发现反应12 h后,目标产物可以77%分离收率得到,产物的α-氘代率几乎不变(95%D)。当反应为24或36小时,虽然产物的α-氘代率下降,但是产物苯环上并无明显的氘代,同时反应完后回收的对甲基苯酚的苯环上也没有明显的氘代。这些氘代实验一定程度上排除了加氢去芳构化-脱氢芳构化的反应机理(图3b)。另外,配合物反应实验进一步支持了π配位活化的机理(图3c)。更进一步地,为了判断催化体系是否均相,作者进行了催化剂毒化实验(详见文章SI),相关结果支持反应为均相体系。
图4. 机理研究。图片来源:J. Am. Chem. Soc.
上述成果近期发表在J. Am. Chem. Soc.上,西湖大学理学院石航特聘研究员为该论文通讯作者,博士研究生陈凯和副研究员康麒凯为论文的共同第一作者。相关后续拓展研究工作正在进行中。
注:苯酚C-O键活化反应可参看施章杰、李朝军(加拿大)、韩福社等老师的工作,非均相催化苯酚胺化可参看李朝军(加拿大)、Katsuhiko Wakabayashi、陈修文等老师的工作。
原文(扫描或长按二维码,识别后直达原文页面):
Catalytic Amination of Phenols with Amines
Kai Chen, Qi-Kai Kang, Yuntong Li, Wen-Qiang Wu, Hui Zhu, and Hang Shi*
J. Am. Chem. Soc., 2022, DOI: 10.1021/jacs.1c12622
导师介绍
石航课题组网站地址:
———END———
限 时 特 惠: 本站每日持续更新海量各大内部创业教程,永久会员只需98元,全站资源免费下载 点击查看详情
站 长 微 信: yjxmw518




