复旦大学附属中山医院 张静
病历摘要
主诉
患者,女,54岁,发热伴咳嗽、咳痰3月,2013年12月12日入院。
现病史
入院前4个月,患者无明显诱因出现咳嗽、咳白痰、盗汗,自觉发热,未测体温。于当地医院予抗感染治疗,1周后无明显好转,咳嗽、咳痰加重,体温最高39.2℃,并出现痰中带血、胸痛。转诊多家医院,先后应用头孢呋辛、亚胺培南/西司他丁、左氧氟沙星、万古霉素抗感染治疗,仍发热,体温多于午后升高,应用退热药物后可降至正常;仍反复咳嗽、咳脓痰、痰中带血,曾有2次咯鲜血3~5口。
2个月前,患者发现左颈部淋巴结肿大,出现腹胀、纳差,伴双下肢水肿。
个人史
有糖尿病病史,未规律治疗,发病以来监测控制不佳(空腹血糖最高12 mmol/L)。
体格检查
体温38℃、脉搏106次/分、呼吸20次/分、血压120/70 mmHg。精神差,消瘦,双下肺呼吸音减低,双肺散在湿音。心前区无隆起,心界不大。双下肢对称性凹陷性水肿。
辅助检查
血液检查
曾有白细胞升高(WBC 13.45×109/L),逐渐出现贫血(Hb 67~83g/L),曾输血支持治疗。肾功能正常范围,病程中白蛋白逐渐下降(最低至19 g/L)、D-二聚体多次显著升高。
胸水检查
黄色、混浊,比重1.025;有核细胞数3.20×109/L,N 60%,嗜酸性粒细胞15%;乳酸脱氢酶(LDH)正常,总蛋白35.4 g/L;未见肿瘤细胞,癌胚抗原(CEA)正常;抗酸杆菌阴性、ADA正常;血培养阴性。
微生物检查
G试验阴性,曾痰培养念珠菌(++),乳胶凝集试验阴性,GM试验阴性。
影像学检查
入院前1个月胸部CT:两肺多发占位,纵隔淋巴结肿大,双侧少量胸腔积液。入院前2周胸部CT:双肺感染并右肺上叶肺脓肿形成,双侧胸腔积液伴双肺下叶节段性膨胀不全。
其他检查
尿常规:红细胞(+)~(++)。左侧颈部淋巴结穿刺细胞学示淋巴结反应性增生。经皮肺穿刺细胞学:未见癌细胞,见少许炎性细胞。经皮肺穿刺病理:右肺中叶肉芽肿性炎伴微脓肿形成,并片状坏死。
问题1—
发热伴肺部多发团片空洞影的病因?
病史特点
中年女性,亚急性、消耗性病程。主要症状是发热、咳嗽、咯血、无脓痰等感染表现。胸部CT提示多发大小不等团块状影,边缘模糊不清,部分空洞形成,另见实变影;病变部位无明显游走性;逐渐出现双侧胸腔积液伴双肺下叶节段性膨胀不全。抗生素治疗无效。重度贫血,血尿,多次活检未见肿瘤依据,曾见肉芽肿性炎伴微脓肿形成。胸水中嗜酸性细胞显著升高。糖尿病控制不佳。农民,可能真菌接触有多次。
诊断和鉴别诊断思路
①感染性疾病:真菌感染如慢性坏死性肺曲霉病?寄生虫病?特殊细菌感染如结核?奴卡菌病?普通细菌感染如金黄色葡萄球菌?
②非感染性疾病:风湿免疫疾病如血管炎?肿瘤如淋巴瘤?肺癌初步可排除。
诊疗经过
进一步检查
血液检查
血常规:RBC 2.28×1012/L、Hb 55 g/L、WBC16.41×109/L、NEUT% 83.0%。肝功能:TB/CB 30.4/10μmol/L、ALT/AST 10/26 U/L、AKP 42 U/L、γ-GT 51 U/L、LDH442 U/L;前白蛋白0. 08 g/L。肾功能:Cr 74μmol/L、BUN 12.5 mmol/L、UA 443μmol/L,肌酐清除率54.58 ml/min。
其他检查
尿常规示红细胞(++)。血、痰、胸水微生物涂片、培养均未见明显异常。抗核抗体颗粒1:100、抗线粒体M2亚型抗体(-)、中性粒细胞胞浆抗体(胞质型)(+)、中性粒细胞胞浆抗体(核周型)(-)、蛋白酶3 >200 RU/ml、类风湿因子242 IU/mL、Coomb’s试验阳性。结核感染T细胞斑点实验(T-SPOT.TB)(-)。寄生虫抗体筛查(-)。
病理快速报告
经皮肺穿刺活检病理快速报告:(肺组织)镜下均为炎性坏死组织,其间可见少量空泡透亮细胞,霉菌性感染不能除外。结合患者临床表现、CT、危险因素、外院病理,考虑肺曲霉病,当日予以伏立康唑抗真菌治疗,等待正式病理检查结果。
病理正式报告
镜下大部分为凝固性坏死及渗出纤维素,较多中性粒细胞及少量浆细胞浸润,其间少许未坏死区域,未见到肉芽肿病变。血管周围及血管壁可见较多淋巴细胞浸润,偶见核分裂相,免疫组化结果示,增生淋巴组织为T淋巴细胞。所做特染未见到霉菌菌丝及孢子,抗酸染色阴性。病理诊断T细胞淋巴瘤不能排除。
问题2—
目前诊断如何考虑?下一步处理?
诊断思路
从临床表现(发热、咳嗽、咯血、抗生素无效)、CT结果(多发团块伴空洞及实变)、危险因素、外院病理(肉芽肿、坏死)来看,提示肺曲霉病。但有如下几点不能完全用肺曲霉病解释:①血尿、②严重贫血、③病理中“可见少量空泡透亮细胞”,通常是隐球菌病的描述,和本例临床经过不符合。同时,正式病理报告淋巴瘤不能除外,如何考虑?
从一元论角度出发,需考虑累及多系统的疾病。结合抗中性粒细胞胞浆抗体(ANCA)、中性粒细胞胞浆抗体(胞质型)、Coomb’s试验阳性的检查结果,高度支持肉芽肿性多血管炎(又称韦格纳肉芽肿,GPA),且能解释患者的全部临床表现(发热、咯血、双肺多发团块影伴空洞、胸腔积液、血尿、溶血性贫血、D-二聚体升高)。病理科、风湿科、血液科多学科讨论,仔细判读病理存在灶性中性粒细胞浸润、小血管炎、小血管壁纤维素样坏死,符合GPA表现,考虑诊断GPA。
后续治疗
患者一般情况差,开始治疗,同时评估眼部、皮损、单神经炎等各系统无特殊表现。治疗方案:静脉甲泼尼龙80 mg q12h×3天、40 mg q12h×2天治疗后改予泼尼松30 mg bid联合羟氯喹100 mg bid口服,并以环磷酰胺0.4 g 1次,同时降血糖、护胃、补充白蛋白、纠正贫血等对症支持治疗。
治疗后,患者发热、咳嗽、咳痰、腹胀、下肢水肿等症状明显好转。复查胸部CT(2013年12月26日):两肺多发炎性肉芽肿伴肺脓肿形成,较前片(2013年12月13日)病灶有吸收;双侧胸腔积液。继续口服泼尼松、羟氯喹等治疗并逐渐减量泼尼松至15 mg bid。1个月后复查,贫血明显纠正,CT(2014年1月8日)示两肺见多发斑片状高密度影,其内见不规则型空腔,部分壁欠光滑,其内未见明显液平,所见支气管未见狭窄,两侧肺门及纵隔内未见明显肿大淋巴结,两侧胸腔内未见积液,病灶较前吸收。治疗效果进一步证实该病例为GPA。
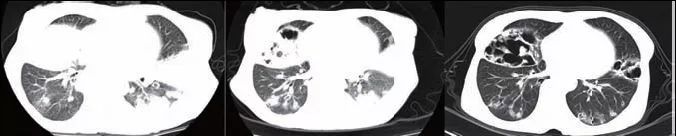
从左至右依次为:2013年12月13日胸部CT、2013年12月26日胸部CT、2014年1月8日胸部CT
随访及转归
泼尼松30 mg bid缓慢减量至20 mg qd联合羟氯喹100 mg bid口服,并以环磷酰胺0.4~0.8 g每月1次。
2014年9月患者出现发热(38℃)伴双耳听力下降、耳鸣,行鼻腔电子镜,右侧咽隐窝活检见黏膜下大量淋巴细胞、浆细胞浸润,内皮细胞增生,可见小血管炎,符合GPA表现。予激素、环磷酰胺冲击治疗,随访肺内病灶吸收好转。
2016年1月随访病情稳定,CT示病灶进一步吸收,维持治疗方案:泼尼松龙20 mg qd、羟氯喹100 mg bid、雷公藤10 mg tid、甲氨蝶呤10 mg qw。
最终诊断
肉芽肿性多血管炎(韦格纳肉芽肿)
诊疗体会
韦格纳肉芽肿是一种系统性、坏死性肉芽肿性血管炎,也是最常见的一种ANCA相关性血管炎,以上呼吸道(如耳、鼻窦、鼻咽、口咽)、下呼吸道(如支气管、肺)和肾脏受累为特征,也常累及周身小动脉、静脉及毛细血管。GPA是一种复杂的自身免疫性疾病,可致多系统受累,临床表现呈多样性,本例是以肺部为首发和主要表现的GPA。
肺部表现可能是系统性疾病的首发就诊原因,出现不能解释的其他系统表现应及早进行相关检查。可通过血清学检查ANCA以及鼻窦和肺部CT扫描辅助诊断。上呼吸道、支气管内膜及肾脏活检是诊断的重要依据。经典的GPA组织病理学特征表现为肉芽肿、局灶性坏死和血管炎三联征,其主要病变部位包括小动脉、静脉及毛细血管,偶亦可累及大动脉。同时应密切结合患者病情分析病理结果,鉴别诊断主要是结节病、淋巴瘤、肺出血肾炎综合征等。治疗上分诱导缓解、维持缓解和控制复发三阶段。初始治疗时环磷酰胺和激素用量不足,疗程不足易导致复发。诱导缓解期的治疗包括应用糖皮质激素冲击治疗及细胞毒药物的治疗,维持缓解期的治疗是小剂量糖皮质激素联合静脉环磷酰胺疗法。在治疗过程中应提高规范化,并注意糖尿病等合并症的控制。
肉芽肿性多血管炎是涉及呼吸内科、耳鼻喉科、眼科、口腔科、肾内科、风湿科等多个学科的临床少见疾病,临床表现多样化,早期诊断困难,误诊率高,治疗后易复发。应提高诊断意识,同时多学科讨论对于综合判断、制定最优诊疗方案非常重要。(博才)
(病例选自2017呼吸慢病管理全能挑战赛全国总决赛)
———END———
限 时 特 惠: 本站每日持续更新海量各大内部创业教程,永久会员只需98元,全站资源免费下载 点击查看详情
站 长 微 信: yjxmw518




